Ophtalmologie
Publié le 02 nov 2022Lecture 12 min
Baisse visuelle chez le patient diabétique : il n’y a pas que la rétinopathie diabétique !
Sylvie FELDMAN-BILLARD, Service de médecine interne, Centre hospitalier national d’ophtalmologie des Quinze-Vingts, Paris
La cataracte, les troubles de la réfraction, le glaucome primitif à angle ouvert (GPAO), la dégénérescence maculaire liée à l’âge (DMLA) et la rétinopathie diabétique (RD) sont les 5 principales causes de baisse visuelle à travers le monde(1). Si la RD est une atteinte oculaire spécifique du diabète, le patient vivant avec un diabète de type 1 (DT1) ou de type 2 (DT2) peut aussi présenter une baisse visuelle en lien avec ces atteintes oculaires(2). Sont-elles plus fréquentes en cas de diabète ? L’hyperglycémie chronique favorise-t-elle leur survenue ? Les variations glycémiques sont-elles un facteur aggravant ? Pour chacune d’entre elles, nous analyserons, au regard des dernières données de la littérature, l’impact du diabète et du contrôle glycémique sur leur survenue. D’autres maladies oculaires fréquentes telles que les occlusions vasculaires rétiniennes, les atteintes neuro-ophtalmologiques ou de la surface oculaire seront également abordées.
│Orientation diagnostique devant une baisse visuelle
Devant une baisse visuelle survenant chez un patient dont le diabète est connu, plusieurs éléments de l’anamnèse, détaillés sur la figure 1, orienteront le diagnostic étiologique.
│Atteinte du cristallin
Cataracte plus fréquente et de survenue plus précoce en cas de diabète
La cataracte est la première cause de baisse visuelle à travers le monde(1). Le diabète en est un facteur de risque connu, au même titre que l’âge avancé, la myopie forte, le tabagisme, l’exposition au soleil ou la corticothérapie. La cataracte est ainsi plus fréquente et de survenue plus précoce chez le patient diabétique comparativement au patient non diabétique. Dans une étude menée au Royaume-Uni, le risque de développer une cataracte était multiplié par 2 dans la population diabétique en comparaison à celle non diabétique. Ce risque était même maximal (x 5) chez les patients âgés de 45 et 54 ans. Le risque de cataracte augmente également avec la durée du diabète et la sévérité de l’hyperglycémie tandis qu’un contrôle glycémique in tensif réduit la nécessité d’une chirurgie de cataracte.
Généralement d’apparition lente sur plusieurs années, la cataracte peut aussi exceptionnellement être d’évolution très rapide et se traduire par une baisse soudaine de la vision. Cette cataracte aiguë à l’aspect particulier en « flocons de neige » (figure 2) survient principalement chez le jeune patient DT1 lors d’une baisse glycémique brutale dans un contexte d’hyperglycémie majeure. Ces patients, à haut risque de développer ultérieurement une RD, doivent bénéficier d’un suivi oculaire rapproché.
Chirurgie de cataracte : bénéfice visuel lié à l’état rétinien
Le seul traitement de la cataracte repose aujourd’hui sur la chirurgie, une des interventions chirurgicales les plus courantes(1). Elle permet dans la grande majorité des cas de rétablir une acuité visuelle satisfaisante. Mais, chez le patient vivant avec un diabète, le bénéfice visuel de la chirurgie peut être réduit, lié principalement au statut rétinien. Ainsi, dans une vaste étude rétrospective britannique incluant 179 159 yeux opérés de cataracte, l’acuité visuelle postopératoire était plus basse chez les patients diabétiques que non diabétiques et négativement corrélée à la sévérité de la RD (p < 0,001)(3). Outre le risque de progression d’une RD après chirurgie de la cataracte, les patients diabétiques sont également plus susceptibles de développer un OMD dans les suites opératoires. Ce risque, estimé au double chez les patients sans RD, était multiplié par 6 en présence d’une RD dans une large étude rétrospective britannique (environ 80 000 yeux opérés de cataracte). Toutes ces données justifient de con trôler au mieux le diabète en période périopératoire pour limiter la survenue de ces complications.
Troubles de la réfraction associés aux grandes variations glycémiques
Le cristallin peut être le siège de modifications en lien avec de grandes variations glycémiques au cours desquelles les patients déclarent volontiers un flou visuel. Ces troubles « réfractifs » sont la conséquence d’une absorption ou d’une excrétion excessive de glucose par le cristallin, modifiant son volume. L’œil devient ainsi le plus souvent hypermétrope, parfois également myope. Ces troubles réfractifs sont principalement décrits lors d’une baisse glycémique brutale chez un patient au diabète très déséquilibré(4). Le patient, souvent inquiet de l’origine de ce flou visuel, doit être rassuré. En effet, ces modifications sont transitoires et le retour à la réfraction antérieure est obtenu en quelques jours à quelques semaines après stabilisation glycémique. Aussi n’est-il pas recommandé de prescrire des verres correcteurs pendant ces périodes de grandes variations glycémiques.
En revanche, les variations glycémiques observées dans la « vraie vie » ne sont pas associées à des modifications de la réfraction. En témoignent les résultats d’une étude comparant les changements réfractifs à intervalle de 2 heures durant 12 heures aux fluctuations glycémiques chez 20 patients DT1 (HbA1c : 8,7 %) et 21 DT2 (HbA1c : 7,6 %). Bien que des variations glycémiques significatives aient été enregistrées durant l’étude, seuls des changements d’importance marginale des paramètres oculaires biométriques ont été observés.
Enfin, dans une analyse récente de l’étude DCCT, alors que la myopie (850/1 439) n’était pas associée à la progression de la RD, l’hypermétropie (45/1 439) était un facteur de risque indépendant de progression de RD et de RDP après ajustement sur la durée du diabète et le taux moyen d’HbA1c par rapport aux patients emmétropes. Encadré 1
│Atteinte de la surface oculaire
Fragilité et hypoesthésie cornéennes : vigilance requise
La cornée du patient diabétique est fragile et volontiers sujette aux érosions. L’atteinte des nerfs cornéens liée à la neuropathie peut entraîner, en outre, une hypoesthésie cornéenne et générer l’apparition d’ulcères à l’origine de cicatrices et d’une morbidité visuelle. Ainsi, une vigilance particulière s’impose chez les patients porteurs de lentilles de contact bien que les matériaux actuels, les lentilles au remplacement quotidien et l’éducation du patient en réduisent les risques.
Sécheresse oculaire fréquente et majorée par l’hyperglycémie
La sécheresse oculaire représente l’un des motifs les plus fréquents de consultation dans la population générale. Une diminution de la production de larmes et/ou une hyperévaporation en sont les principaux mécanismes. Les patients vivant avec un diabète sont particulièrement concernés avec près de 4 patients sur 10 atteints de sécheresse oculaire dans une étude cas-témoins et un risque accru de 30 % par rapport à des sujets contrôles dans une métaanalyse impliquant plus de 2,5 millions de personnes(5). En outre, dans une étude où 18 % des patients DT2 présentaient une sécheresse oculaire vs 6 % des contrôles (p < 0,001), ceux au contrôle glycémique précaire étaient plus susceptibles de présenter une sécheresse oculaire.
Augmentation modeste du risque de conjonctivite en cas de diabète
Tandis que les personnes atteintes de diabète sont plus exposées aux infections, seule l’incidence de la conjonctivite était accrue chez les 3 273 patients DT1 (OR : 1,61 [IC95% : 1,38-1,88] ou les 45 311 DT2 (OR : 1,11 [IC95% : 1,06-1,16] comparés aux 938 440 sujets non diabétiques dans une étude britannique(6). Aucune association n’était en revanche observée entre diabète et blépharite, orgelet, chalazion, cellulite périorbitaire, kératite, kératoconjonctivite ou infection des glandes lacrymales dans cette étude pourtant menée à très grande échelle. Encadré 2
│Glaucome
Le diabète augmente le risque de glaucome primitif à angle ouvert
Le glaucome primitif à angle ouvert (GPAO) représente la deuxième cause de baisse visuelle dans le monde(1). Le GPAO est une neuropathie optique caractérisée par une destruction progressive du nerf optique associée à des altérations du champ visuel. Les patients, longtemps asymptomatiques, doivent bénéficier d’un dépistage, notamment ceux aux antécédents familiaux de GPAO. Le principal facteur de risque est l’hypertonie oculaire, même si un certain nombre de patients pourtant atteints de GPAO n’ont pas d’augmentation de la pression intraoculaire. Enfin, le traitement repose sur l’administration de collyres complétée par la réalisation de laser ou de chirurgie dans certains cas.
Si la relation entre diabète et GPAO demeure controversée, de nombreuses études suggèrent que les patients vivant avec un diabète ont un risque accru de GPAO. En témoignent les résultats d’une vaste étude coréenne où la prévalence du GPAO était plus élevée après un suivi de 11 ans chez les patients diabétiques (3,3 %) que chez ceux sans diabète (1,9 %) (p < 0,0001)(7). La durée du diabète a aussi été identifiée comme facteur de risque de glaucome, celui-ci augmentant de 5 % par année de diabète. L’équilibre glycémique semble également jouer un rôle puisque, dans une étude incluant 370 000 sujets coréens, le risque de GPAO était 60 % plus élevé chez les patients dont la glycémie dépassait 160 mg/dL en comparaison à ceux aux valeurs normales. Enfin, l’association entre GPAO et RD est discutée bien que des mécanismes communs semblent contribuer au lien possible entre GPAO et RD.
Pas d’augmentation du risque de glaucome aigu par fermeture de l’angle
Le glaucome aigu par fermeture de l’angle (GAFA) est une urgence oculaire et nécessite un traitement immédiat. Les symptômes comprennent des douleurs oculaires, une vision floue, des céphalées, des nausées et des vomissements. Pour autant, le GAFA ne semble pas plus fréquent en cas de diabète, sauf peut-être en cas d’hyperhydratation du cristallin lors d’une hyperglycémie majeure.
Glaucome néovasculaire : complication d’une RDP ou d’une occlusion veineuse rétinienne
Quant au glaucome néovasculaire (GNV), sa fréquence est indiscutablement augmentée en cas de diabète, un GNV pouvant compliquer une RDP ou une occlusion veineuse rétinienne (OVR). Il peut être également la conséquence d’une ischémie oculaire sur sténose carotidienne. Le classique syndrome d’ischémie oculaire en représente un exemple au cours duquel le diabète est souvent présent (56 % des patients d’une série). Encadré 3
│Atteinte neuro-ophtalmologique
Risque accru de neuropathie ischémique antérieure aiguë en cas de diabète
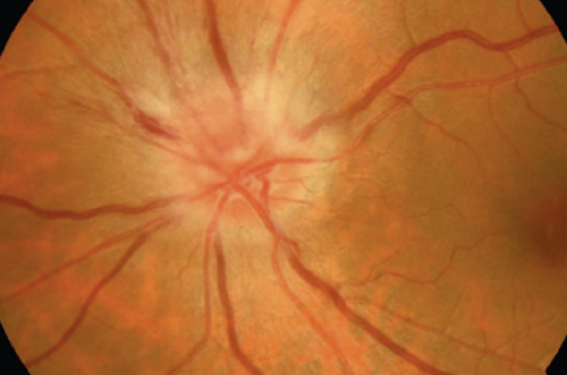
La neuropathie optique ischémique antérieure aiguë (NOIAA) correspond à une atteinte ischémique de la tête du nerf optique non due à la maladie de Horton. Elle se manifeste par un œdème papillaire (figure 3) avec baisse visuelle souvent sévère et d’apparition brutale. Le diabète, retrouvé chez 25 % des patients présentant une NOIAA non artéritique, augmente aussi de 60 % le risque de survenue de cette atteinte oculaire dans une métaanalyse(8). Pour autant, le pronostic visuel apparaît similaire chez les patients diabétiques comparés à ceux non diabétiques présentant une NOIAA dans une étude rétrospective. Enfin, si un facteur anatomique (papille « à risque » souvent constatée dans l’œil controlatéral) prédispose à cette atteinte et qu’aucun traitement curatif n’est démontré à ce jour, corriger l’ensemble des facteurs de risque vasculaire, dont le diabète, est essentiel chez ces patients à haut risque vasculaire.
Papillopathie diabétique : impact des grandes variations glycémiques
La papillopathie diabétique est une affection rare, retrouvée chez seulement 1 % des 3 235 patients d’une étude rétrospective. Elle concerne principalement le patient DT1 et se manifeste par un œdème papillaire uni ou bilatéral. Son évolution est souvent favorable bien que dans certains cas, elle puisse être responsable de séquelles fonctionnelles, notamment si elle est associée à une RD. Une baisse rapide et profonde de la glycémie précédant son apparition a été rapportée, suggérant un impact des grandes variations glycémiques dans la survenue de cette atteinte oculaire(9).
Paralysie oculomotrice dans un contexte d’hyperglycémie chronique
Secondaires à une neuropathie diabétique, les paralysies oculomotrices (POM) peuvent atteindre la troisième, la quatrième ou la sixième paire crânienne. Elles se manifestent par une diplopie binoculaire sans anomalie pupillaire et apparaissent souvent dans un contexte de déséquilibre du diabète. Leur fréquence a été estimée à 0,40 % parmi une population hospitalière de 6 765 sujets diabétiques tandis que la survenue d’une POM de la sixième paire crânienne était 5 fois plus fréquente en cas de diabète dans une étude rétrospective.
Elle peut aussi révéler le diabète, imposant la mesure d’une glycémie devant toute POM. La récupération est habituelle en quelques semaines, aidée par la prise en charge des facteurs de risque vasculaire, au premier rang desquels le contrôle glycémique, un des mécanismes incriminés étant une micro-occlusion vasculaire. Les récidives possibles sont certainement favorisées par les déséquilibres glycémiques récurrents. L’association d’anomalies pupillaires ou d’autres troubles neurologiques doit faire rechercher une cause compressive (neuro-imagerie), le diabète restant un diagnostic d’élimination. Encadré 4
│Atteinte rétinienne en dehors de la RD et OMD
Formes sévères d’occlusion veineuse rétinienne associées au diabète
L’occlusion veineuse rétinienne (OVR) est caractérisée par une obstruction de la veine centrale de la rétine (OVCR) ou de l’une de ses branches (OBVR). Il s’agit de l’atteinte vasculaire rétinienne la plus fréquente après la RD ; sa prévalence augmente avec l’âge. L’examen ophtalmologique retrouve des veines tortueuses et dilatées associées à des hémorragies (figure 4). Le patient décrit une baisse d’acuité visuelle indolore de survenue rapide et dont l’importance est fonction de la gravité de l’occlusion. Le traitement repose sur des injections intravitréennes complétées ou non par du laser. Si le diabète semble représenter un facteur de risque modeste de survenue d’OVR au regard des autres facteurs de risque (principalement HTA et GPAO) avec une augmentation de risque uniquement des OVCR de 60 % dans une étude(10), le diabète expose à des formes plus sévères d’OVR assorties d’un pronostic visuel plus péjoratif.
Le diabète double le risque d’occlusion artérielle rétinienne
L’occlusion artérielle rétinienne (OAR), plus rare que l’OVR dans la population générale, se caractérise à l’examen par une coloration rouge cerise de la macula contrastant avec une pâleur ischémique rétinienne (figure 5). Elle se traduit par une baisse brutale et indolore de la vision, pouvant aller jusqu’à la cécité complète. Cet accident ischémique rétinien s’associe à un risque accru de présenter un autre accident vasculaire dans les semaines suivant sa survenue. Considéré comme une urgence, le patient doit être dirigé vers un service dédié aux urgences neuro-vasculaires. Le risque de survenue d’une OAR est estimé au double en cas de diabète dans une vaste étude taïwanaise rétrospective(11). Même si l’absence de données glycémiques dans cette étude ne permet pas d’analyser l’influence du contrôle glycémique sur le risque d’OAR, le contrôle du diabète fait partie intégrante de la prise en charge de ces patients à haut risque vasculaire.
Le diabète n’augmente pas le risque de dégénérescence maculaire liée à l’âge (DMLA) Alors que la DMLA est la première cause de malvoyance chez les patients âgés dans les pays européens avec une prévalence à la croissance exponentielle avec l’âge (jusqu’à 25 à 30 % après 75 ans), le diabète ne semble pas, quant à lui, favoriser le développement de cette atteinte oculaire. En effet, l’incidence de la DMLA non exsudative (sèche), le type le plus fréquent, était similaire chez les patients atteints ou non de diabète dans une étude rétrospective taïwanaise à grande échelle (plus de 50 000 patients diabétiques appariés à 50 000 non diabétiques). Les résultats étaient néanmoins plus discutés concernant le type exsudatif (humide) qui conduit à la plupart des cas de basse vision. En outre, le risque de DMLA était réduit de moitié en cas de diabète dans 2 autres études. Dans la première étude rétrospective incluant plus de 40 000 patients à un stade précoce de DMLA, tandis que l’âge, le sexe féminin et les maladies cardiovasculaires augmentaient le risque de progression vers une forme avancée de DMLA, le diabète était au contraire associé à une diminution de moitié de ce risque(12). La survenue d’une DMLA était aussi réduite de 44 % (p < 0,001) dans la deuxième étude.
Il est intéressant de mettre en perspective ces résultats avec ceux de trois études récentes suggérant un bénéfice du traitement par metformine dans la réduction du risque de DMLA associé au diabète. Dans la première étude rétrospective fondée sur les données de l’assurance maladie taïwanaise de 2001 à 2013, parmi les 68 205 sujets DT2 inclus, ceux traités par metformine (n = 45 524) avaient un risque réduit de développer une DMLA (HR ajusté = 0,57 [IC95% : 0,52- 0,63]) comparés aux 22 681 sujets n’en utilisant pas(13). En outre, plus le traitement par metformine était de longue durée, plus le risque diminuait. Des résultats du même ordre ont été observés dans la seconde étude rétrospective menée en Floride où les patients sous metformine développaient plus rarement une DMLA (OR ajusté = 0,58 [IC95% : 0,43-0,79])(14). Enfin, dans une étude cas-témoins toute récente utilisant une base de données d’assurance maladie américaine, les personnes sous metformine présentaient un risque réduit de 5 à 10 % de développer une DMLA par rapport à celles non traitées par metformine(15). Cette association était dose-dépendante avec, étonnamment, le bénéfice le plus élevé observé avec une dose faible à modérée de metformine.
Rétinopathie hypertensive : signes intriqués avec ceux de la rétinopathie diabétique
La coexistence d’une rétinopathie hypertensive et d’une RD chez le patient diabétique est fréquente et doit être évoquée même si leurs signes spécifiques peuvent être difficiles à reconnaître, car intriqués. Plus de 14 % des 22 771 patients bénéficiant d’un programme de dépistage de la RD en Nouvelle-Zélande présentaient une rétinopathie hypertensive avec une fréquence similaire selon les tranches d’âge. L’obtention d’un contrôle tensionnel optimal est alors impérative et permettra en outre de freiner l’évolution d’une RD ou d’une OMD, éventuellement associées.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :