Publié le 14 avr 2013Lecture 10 min
Retrouver des cellules bêta : quelles perspectives ?
M. DEKER
Journées Lilly Diabète
Les greffes de pancréas ou d’îlots de Langerhans ne sont pas encore, loin s’en faut, de pratique courante et ce, pour de multiples raisons, dont le manque de greffons. Toutefois, les techniques progressent et les résultats s’améliorent. La recherche de solutions alternatives pour contourner la pénurie de cellules à greffer et éviter les protocoles d’immunosuppression se développe.
Bilan de la transplantation pancréatique
Le recours à la transplantation pancréatique est 5 à 10 fois moins fréquent en France que dans d’autres pays européens ou aux États-Unis. En 2011, 75 transplantations ont été réalisées, dont 67 greffes rein-pancréas, 6 greffes de pancréas seul et 2 greffes multiviscérales. La double greffe, qui s’adresse à des patients diabétiques en insuffisance rénale chronique, a pourtant largement démontré son bénéfice comparativement à la transplantation rénale seule ou à l’insulinothérapie seule. Une greffe pancréatique peut aussi être réalisée secondairement à une transplantation rénale (PAK, pancreatic after kidney) ou être réalisée isolément sans greffe rénale, chez des patients diabétiques de type 1 très instables ou ayant des complications dégénératives rapidement progressives.
Depuis les premières transplantations réalisées dans les années 1960, la technique chirurgicale a beaucoup évolué. Il s’agit aujourd’hui d’une transplantation comprenant non seulement le pancréas mais le cadre duodénal. Les voies de dérivation des produits des fonctions exocrines du pancréas (soit 98 % du volume de la glande) varient : dans le tube digestif ou les voies urinaires, par drainage veineux dans le système porte. Ces variations techniques, qui dépendent des opportunités chirurgicales, visent principalement à permettre la surveillance de la viabilité du greffon (au mieux par biopsie). Pour les transplantations pancréatiques isolées ou secondaires, de nouvelles stratégies consistent à implanter le pancréas en extrapéritonéal ou à transposer le bloc duodéno-pancréatique en position haute, toujours pour faciliter la surveillance du greffon.
Des résultats fonctionnels satisfaisants
En effet, 85 % des pancréas et des reins greffés sont fonctionnels à 1 an, 50 % à 10 ans ; la greffe pancréatique non seulement permet de recouvrer une insulino-indépendance, mais elle assure une meilleure survie du greffon rénal. La transplantation pancréatique permet de stabiliser les complications de la maladie diabétique (rétinopathie, néphropathie, neuropathie) et améliore la qualité de vie. Elle améliore la survie des diabétiques instables dont la fonction rénale est préservée avec toutefois davantage de rejets chroniques.
Ces bénéfices doivent être considérés en regard des risques chirurgicaux et liés au traitement immunosuppresseur. La transplantation pancréatique est une intervention lourde, grevée de sévères complications : cardiovasculaires (10 % d’infarctus du myocarde), chirurgicales (reprises, 20 % ; hémorragies, 25 % ; thromboses de la veine hépatique, 5-10 % ; fistules digestives, 4 %) ; mortalité de cause cardiovasculaire, infectieuse, carcinologique et chirurgicale.
Les critères de sélection du receveur (âge < 55 ans) et du donneur (< 45 ans, IMC bas < 27 kg/m2) sont stricts et limitent encore les indications de la greffe pancréatique seule, d’autant plus que les résultats de la greffe d’îlots progressent.
Les limites de la greffe d’îlots pancréatiques
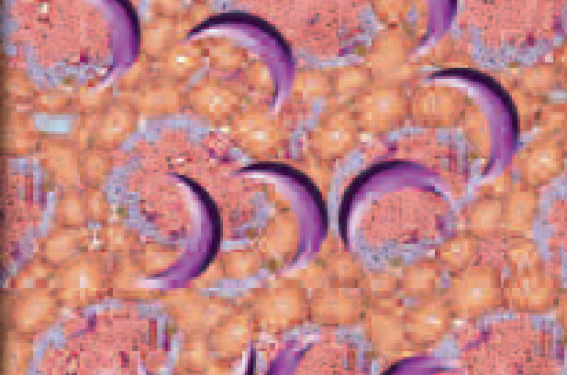
La greffe d’îlots pancréatiques, procédure moins lourde que la greffe de pancréas, n’en reste pas moins sujette aux mêmes principes et aléas du don d’organe et requiert même deux donneurs par patient aujourd’hui. Il s’agit toujours d’une procédure thérapeutique expérimentale dans le cadre d’essais cliniques, avec des résultats en voie d’amélioration. Les îlots sont introduits par voie porte et vont se nicher dans les capillaires hépatiques (figure).
Avec les nouveaux protocoles d’immunosuppression alliant une induction plus forte, une déplétion en lymphocytes T, l’utilisation de tacrolimus à pleine dose et des traitements anti-inflammatoires, tels des anti-TNFα pour surmonter la phase inflammatoire initiale, les résultats ont nettement progressé.
Ainsi, une récente publication du registre international des transplantations d’îlots pancréatiques montre que la durée d’insulino-indépendance à 3 ans peut atteindre 50 à 70 % dans certains centres, soit des résultats comparables à ceux de la transplantation de pancréas entier. Parmi les patients ayant bénéficié de cette greffe, environ 90 % gardent des îlots fonctionnels à 3-4 ans, comme en atteste la positivité du peptide C, ce qui garantit un taux d’HbA1c bas et stable, ainsi que l’absence d’hypoglycémies.
Les effets de la greffe d’îlots sur les complications dégénératives du diabète ne reposent que sur un faible niveau de preuves en raison du petit effectif des séries. Il a néanmoins été observé un bénéfice sur la progression de la neuropathie et de la néphropathie, une amélioration des symptômes neurovégétatifs, un effet sur l’épaisseur intima-média et une moindre dégradation de la fonction rénale chez les patients ayant bénéficié antérieurement d’une greffe de rein.
Malgré ces résultats encourageants, la greffe d’îlots reste une procédure complexe, nécessitant un protocole d’immunosuppression avec les complications qui s’y rattachent, outre les complications liées à la procédure (hématome sous-capsulaire, entre autres) et le risque d’allo-immunisation tenant à l’utilisation de plusieurs donneurs par patient, ce qui obère les possibilités de regreffe ou d’autre greffe d’organe. Ses indications sont donc très limitées, après avoir bien pesé le bénéfice/ risque : patients diabétiques très instables (hypoglycémies sévères, comas), sans complications dégénératives installées, dont les besoins en insuline ne sont pas trop importants (donc sans surpoids), ou après greffe de rein ou échec de transplantation pancréatique.
La faible disponibilité des îlots à greffer et la nécessité d’un protocole d’immunosuppression chronique, dont les conséquences délétères pourraient surpasser les bénéfices métaboliques de la greffe, sont les principales limites de la greffe d’îlots. Elles motivent la recherche d’autres sources d’îlots pancréatiques et de procédés de préparation et d’implantation des îlots, qui les mette à l’abri du rejet sans nécessité d’immunosuppression.
Vers des xénogreffes d’îlots sans immunosuppression
Une piste explorée, notamment par l’équipe de Pierre Gianello, est l’utilisation d’îlots pancréatiques porcins, encapsulés dans des billes d’alginate. L’insuline de porc, proche de celle de l’homme, a longtemps été utilisée pour traiter le diabète de l’homme ; les cellules pancréatiques porcines sont stables, ce qui exclut les risques de tumorogenèse, et elles peuvent donner des résultats physiologiques suffisants. Enfin, il est possible de créer des élevages de porc dans des conditions de sécurité extrême, qui assureraient une abondante source d’îlots encore plus sûre que les allogreffes humaines.
Des expérimentations ont été réalisées sur un modèle de primate (qui possède des anticorps dirigés contre le tissu porcin) rendu diabétique, avec des résultats encourageants, soit une correction du diabète pendant 6 mois à 1 an, sous couvert d’une immunosuppression encore trop forte. Ce modèle expérimental est en train d’évoluer dans le sens d’une modification génétique des donneurs porcins, pour aboutir à des îlots de porc beaucoup moins immunogènes.
Plusieurs études ont déjà rapporté les résultats de microencapsulation d’îlots humains en allo-transplantation. L’encapsulation est principalement réalisée avec des alginates, polysaccharides extraits des algues, qui servent de barrière à la pénétration des anticorps et sont relativement peu attractifs pour les cellules du système immunitaire. Le procédé d’encapsulation est cependant délicat, pour éviter la protrusion des îlots hors de la bille et leur rejet consécutif. Chez le primate, l’implantation de ces îlots encapsulés sous la capsule rénale permet de corriger le diabète pendant 2-3 semaines, sans avoir à utiliser un protocole d’immunosuppression ; des résultats comparables ont été obtenus après une implantation péritonéale.
Pour pallier ces limites est née l’idée de modifier la préparation des îlots. Ces derniers sont placés sur un support collagénique en fascia lata décellularisé, le tout étant recouvert d’alginate. L’ensemble forme un patch de petite taille, qui est inséré en sous-cutané. Chez le primate, cette modalité d’implantation des îlots a pu corriger le diabète pendant 5 à 6 mois, sans immunosuppression médicamenteuse. La réponse insulinique est correcte mais retardée. Au bout de 6 mois, l’effet du remplacement cellulaire s’épuise, mais il est possible de réimplanter un nouveau patch. Une amélioration de cette modalité thérapeutique pourrait venir du couplage des îlots avec des cellules souches, qui ont montré leur capacité à favoriser la croissance cellulaire, diminuer l’apoptose et améliorer l’oxygénation. Sur le support collagénique ont donc été ajoutées des cellules souches mésenchymateuses issues de la moelle osseuse ou du tissu adipeux ; ce procédé a permis d’allonger la survie des cellules greffées, sans doute en liaison avec une amélioration de l’angiogenèse, avec des corrections glycémiques plus longues.
Le concept de ce patch sous-cutané est actuellement testé chez l’homme avec des îlots humains, chez des patients transplantés rénaux, donc sous immunosuppression, dans le cadre d’un essai de sécurité/tolérance. Chez un premier patient, il a été montré une stabilité de l’implant en sous-cutané, une absence de réaction inflammatoire, une amélioration de l’équilibre glycémique et une diminution des besoins en insuline. Ces premières expérimentations sont prometteuses mais elles mettent en lumière les limites en termes de durabilité de ce système de greffe d’îlots, d’où l’expérimentation d’autres systèmes de réservoirs bio-implantables ou de sites d’implantation, par plusieurs équipes dans le monde.
Comprendre le développement des cellules … pour les générer massivement
Une autre piste de recherche pourrait à terme fournir une alternative aux cellules de donneurs et aux cellules porcines : le développement de cellules β en culture, afin de mieux com prendre comment ces cellules se développent et définir de nouvelles approches thérapeutiques. L’idée sous-jacente est de partir de cellules totipotentes (cellules souches) pour générer des cellules β productrices d’insuline, procédure qui s’est avérée très complexe contrairement aux présupposés. La stratégie consiste, d’abord, à comprendre comment les cellules pancréatiques se développent dans un pancréas de rongeur normal puis à tenter de répliquer ce système dans un milieu de culture à partir de cellules souches.
Les travaux d’une biothèque ont montré qu’il est possible de progresser dans la formation de cellules pancréatiques endocrines à partir de cellules souches humaines, notamment de générer de l’endoderme (feuillet embryologique à partir duquel vont se développer les progéniteurs pancréatiques) et des progéniteurs pancréatiques, mais pas des cellules β ; le procédé développé par cette biothèque reste globalement inefficace.
L’objectif de l’équipe Inserm de Raphaël Sharfmann, en collaboration avec celle de Philippe Ravassard, est d’abord d’identifier les signaux qui régulent la multiplication des cellules pancréatiques et leur différenciation en cellules β fonctionnelles, sur des modèles de rongeurs. Un autre enjeu sera de transférer vers des modèles humains les informations recueillies sur les modèles animaux.
Un modèle développé chez la souris a montré qu’il est possible à partir de progéniteurs pancréatiques humains d’induire leur multiplication puis leur transformation en cellules β fonctionnelles ; ce modèle pourrait être utile pour générer des lignées de cellules β humaines, permettant d’étudier le fonctionnement et le dysfonctionnement de ces cellules. L’équipe de R. Sharfmann a réussi, par un processus multiétapes partant de pancréas foetal humain, à générer une lignée de cellules β dénommée EndoC- βH1 produisant de l’insuline humaine(1).
Générer des cellules en masse est un enjeu important pour comprendre le développement de ces cellules et les anomalies de leur développement, pour répliquer leur développement en culture, et enfin pour développer de nouvelles thérapies de type cellulaire et régénérative.
XXIIes Journées Lilly Diabète, 24-25 janvier 2013. D’après les communications de L. Badet (Lyon), A. Wojtusciszyn (Montpellier), P. Gianello (Bruxelles), R. Sharfmann (Paris) et T. Berney (Genève).
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :




