Publié le 15 oct 2017Lecture 10 min
Les insulines ultra-rapides aujourd’hui : un petit plus en espérant mieux pour demain
Louis MONNIER, Claude COLETTE, Institut universitaire de recherche clinique, Montpellier
Allonger la durée d’action des insulines basales et raccourcir celle des prandiales pour obtenir des formes ultra-longues ou ultra-rapides, tels sont les deux grands défis en termes de préparations insuliniques et d’insulinothérapie(1). Dans cet article, notre propos sera focalisé sur les insulines ultra-rapides.
L’objectif des insulines ultrarapides est de présenter des profils pharmacocinétiques et pharmacodynamiques aussi proches que possible des incréments glycémiques normalement observés après un repas glucidique. Chez une personne qui n’est pas diabétique, tout repas qui apporte des glucides est suivi par une montée glycémique dont les caractéristiques sont décrites sur la figure 1A. Le pic, qui dépasse rarement 1,40 g/l (7,8 mmol/l), est atteint vers la 30e minute après le début de la prise alimentaire. La durée de l’incrément glycémique au-dessus de la ligne de base reste, quant à elle, toujours en-deçà de 2 heures (figure 1A). Chez un sujet non diabétique, l’amplitude et la durée de la montée glycémique restent en dessous des limites que nous venons de décrire grâce à la réponse insulinique qui suit la prise d’aliment glucidique. Cette réponse est en général parallèle à la montée glycémique avec un léger décalage dans le temps (figure 1A). Chez les diabétiques insulinés, en particulier de type 1, où la réponse insulinique endogène est inexistante, les montées glycémiques postprandiales sont sous la dépendance de l’insuline « prandiale » qui a été injectée avant le début de la prise alimentaire.
Figure 1. Profils glycémiques et insulinémiques chez des sujets témoins et chez des patients diabétiques de type 1 après un repas glucidique. Dans le premier cas (A), la réponse insulinémique est celle de l’insulinosécrétion endogène. Dans le deuxième cas (B), le profil insulinémique correspond à l’incrément de l’insuline plasmatique après une injection préprandiale d’un analogue rapide.
Pendant de nombreuses années, les insulines prandiales ont été représentées par les insulines ordinaires ou régulières avec un pic d’activité qui se situait entre la 1re et la 2e heure après l’injection et avec une durée d’action se prolongeant jusqu’à la 6e heure(2,3), voire au-delà. L’apparition des analogues rapides (lispro, asparte et glulisine)(2-7) a profondément modifié le paysage des insulines prandiales en permettant l’obtention d’insulines dont le pic d’activité se situe entre la 30e et la 60e minute après l’injection et dont la durée totale d’action est comprise entre 3 et 4 heures (figure 1B). Grâce à ces analogues rapides de l’insuline, il a été possible de réduire l’amplitude et la durée des excursions glycémiques postprandiales ainsi que l’incidence des hypoglycémies à distance des repas entre la 3e et la 4e heure après la prise alimentaire. En effet, le profil des insulinémies est nettement amélioré comparativement à celui qui était obtenu avec les insulines ordinaires(2,3), même si les incréments insulinémiques après une injection d’analogue rapide ne sont pas identiques à ceux observés en période postprandiale chez une personne non diabétique.
Est-il possible de faire mieux ? C’est le défi qui a été lancé par les concepteurs des préparations insuliniques dites « ultrarapides »(8-15) ou de tous les procédés qui permettent d’accélérer l’absorption des insulines après leur injection sous-cutanée.
Méthodes d’obtention des insulines ultra-rapides
À ce jour, une seule méthode connaît une application pratique avec la commercialisation de l’insuline Faster-Aspart (Fiasp®)(10-15). Les autres restent pour l’instant du domaine de la recherche.
Insuline Faster-Aspart
Elle est obtenue en ajoutant à la préparation d’insuline Asparte deux excipients bien répertoriés (la nicotinamide ou vitamine PP et la L-arginine), qui permettent, d’une part, de stabiliser la préparation et, d’autre part, d’accélérer la résorption de l’insuline après injection dans le tissu cellulaire sous-cutané. La nicotinamide induit en particulier la formation de monomères de l’insuline qui traversent plus rapidement les endothéliums vasculaires(16) et qui sont immédiatement actifs après fixation sur les récepteurs spécifiques de l’insuline au niveau des cellules hépatiques et périphériques (musculaires, adipeuses, etc.). Les études de pharmacocinétique et de pharmacodynamie (PK/PD)(10-13), qui ont été réalisées en comparant la Faster-Aspart à son produit mère l’insuline Asparte ont montré, à doses identiques, un décalage de l’ordre d’une dizaine de minutes (vers la gauche) pour l’insuline Faster-Aspart, ce qui témoigne d’un incrément insulinémique plus précoce (figure 2)(12).
Figure 2. Évolution de l’insulinémie après injection à dose équivalente (0,2 unité/kg) d’un analogue rapide de l’insuline (Insuline Asparte) et de son correspondant sous forme ultra-rapide (Faster-Aspart) chez des sujets ayant un diabète de type 1 (d’après la référence 12).
Les conséquences sont les suivantes :
– un pic insulinémique plus précoce (10 minutes environ) pour la Faster-Aspart ;
– une descente insulinémique parallèle avec des pentes identiques pour les 2 préparations ;
– un profil pharmacodynamique (quantité de glucose infusée par unité de temps pour maintenir la glycémie à la normale) en avance de 10 minutes pour la Faster-Aspart comparativement à l’Asparte.
Au niveau des glycémies postprandiales, l’incrément absolu de la glycémie est légèrement plus faible avec la Faster-Aspart qu’avec l’Asparte (figure 3)(13). Le différentiel entre les incréments postprandiaux au niveau des pics est compris entre 0,10 g/l (0,55 mmol/l) et 0,40 g/l (2,2 mmol/l). Ce différentiel persiste dans la période de descente glycémique. Si on calcule la réduction des incréments glycémiques moyens entre le temps 0 (injection) et la 2e heure avec la Faster-Aspart, elle est extrêmement variable, comprise entre -0,036 g/l (chez les adolescents) et -0,27 g/l (chez les adultes)(13). Si on considère que les incréments glycémiques postprandiaux sont en moyenne de l’ordre de 0,70 g/l (3,9 mmol/l) sur une période de 2 heures avec l’insuline Asparte, on peut conclure que, dans le meilleur des cas, la réduction de l’exposition au glucose sur la période postprandiale est de l’ordre de 33 % (aire en jaune sur la figure 3) avec la Faster-Aspart comparativement à l’Asparte. Dans le plus mauvais des cas, la réduction est proche de 0 %. D’une manière générale, la réduction semble se situer aux alentours de 20 %. Étant donné que l’impact global des excursions glycémiques postprandiales sur l’HbA1c est en moyenne de 1 % (en point de pourcentage d’HbA1c)(17), on devrait s’attendre à une réduction de l’ordre de 0,2 % (en point de pourcentage d’HbA1c) en remplaçant à chaque repas un analogue rapide préprandial (type Asparte) par une préparation d’ultra-rapide (type Faster-Aspart).
Figure 3. Incréments de la glycémie au-dessus de la ligne de base chez des adultes diabétiques de type 1 après un repas glucidique précédé par une injection d’insuline Asparte ou de son correspondant sous forme ultra-rapide (Faster-Aspart). La différence entre les moyennes des incréments glycémiques postprandiaux sur 2 heures entre l’insuline Faster-Aspart et l’Asparte a été chiffrée à 0,27 g/l, soit 1,6 mmol/l. En première approximation, on peut considérer que l’amplitude des excursions glycémiques postprandiales a été réduite de 33 % (différence représentée par l’aire jaune) (d’après la référence 13).
La prédiction théorique est-elle en accord avec ce qui est observé en pratique ?
La réponse a été donnée par 2 études publiées récemment dans la revue Diabetes Care(14,15). Toutes deux ont été effectuées chez des patients diabétiques de type 1(14) ou de type 2(15) traités par des schémas insuliniques de type basal-bolus, dans lesquels les bolus préprandiaux étaient administrés soit sous forme de Faster-Aspart, soit sous forme d’Asparte. Au bout de 26 semaines de traitement, on note chez les patients diabétique de type 1(14) que l’HbA1c est légèrement plus basse dans le bras Faster-Aspart que dans le bras Asparte (différentiel = 0,15 % en point de pourcentage d’HbA1c) (figure 4). En revanche, les taux d’HbA1c sont strictement identiques au bout de 26 semaines chez les patients diabétiques de type 2, qu’ils soient traités par de la Faster-Aspart ou par de l’Asparte. En ce qui concerne les hypoglycémies, leur incidence est identique, que les patients soient traités par Faster-Aspart ou par Asparte. Chez les patients diabétiques de type 2(15), on note même une légère augmentation de la fréquence des hypoglycémies avec la Faster-Aspart dans la période postprandiale couvrant les 2 heures qui suivent les repas.
Figure 4. Évolution sur 26 semaines de l’HbA1c chez des patients diabétiques de type 1 soumis à un traitement insulinique de type basal-bolus. Les bolus d’insulines prandiales sont administrés sous forme de Faster-Aspart ou d’Asparte classique au début de chaque repas (d’après la référence 14).
La conclusion de ces 2 études est que les résultats en termes d’efficacité (exposition à l’hyperglycémie) et de sécurité sont soit extrêmement discrets, soit nuls. À la lumière de ces résultats, il est indiscutable que les avantages potentiels des insulines ultra-rapides dans leur formulation actuelle n’apparaissent pas de manière claire. Les conclusions des 2 articles précités sont loin d’être bouleversantes.
Dans le type 1, les conclusions des auteurs(14) sont les suivantes : la Faster-Aspart n’est pas inférieure à l’Asparte en termes d’HbA1c et elle n’entraîne pas davantage d’hypoglycémies que l’Asparte.
Dans le type 2(15), les auteurs ont été conduits aux conclusions suivantes : le passage d’un schéma basal à un schéma basal-bolus entraine une amélioration identique du contrôle glycémique, que la modalité de l’intensification du traitement insulinique ait été réalisée avec la Faster-Aspart ou avec l’Asparte. On pourrait dire que le « service minimum » a été assuré. Pour y voir plus clair, il faudra certainement disposer d’insulines ultrarapides plus performantes en termes de rapidité de résorption après injection sous-cutanée.
Dans ces conditions, y a-t-il d’autres voies envisageables pour accélérer l’absorption des insulines dites « prandiales » ?
Production d’insulines ultra-rapides par d’autres méthodes
• Une première voie
Elle consiste à ajouter à la préparation insulinique une hyaluronidase destinée à « digérer » le hyaluronan, l’un des composants du collagène du tissu cellulaire sous-cutané(9). Avec sa consistance de gel, il freine la diffusion des médicaments injectés, mais sa digestion sous l’influence d’une hyaluronidase facilite la diffusion de l’insuline après son injection sous-cutanée. Pour l’instant, cette voie ne semble pas répondre aux promesses qu’elle avait fait naître.
• Une deuxième voie
C’est celle des « biochaperonnes »(8). Les « chaperonnes » sont normalement des protéines sécrétées par les cellules, qui permettent d’assembler et de plicaturer d’autres protéines (l’insuline par exemple) pour leur conférer leur structure tertiaire tridimensionnelle en les emmitouflant dans une chape protectrice comme le faisaient certaines coiffes utilisées pour protéger les coiffures des Françaises vivant au XVIe siècle. Cette coiffe était appelée « chaperon ». Ce terme d’origine française a été repris par les scientifiques pour désigner les protéines qui jouent un rôle dans l’emmitouflage des autres protéines afin d’assurer et de maintenir leur configuration spatiale idéale et définitive. Ce procédé a été utilisé pour tenter de développer une forme ultra-rapide de l’insuline lispro(8), le « biochaperon » étant un polysaccharide voisin de l’héparine et ayant la propriété de se complexer de manière réversible à l’insuline pour la protéger, la stabiliser et in fine pour contrôler sa libération. Bien que cette technologie soit potentiellement prometteuse, elle semble elle aussi ne pas tenir toutes ses promesses, du moins pour la production d’insulines ultra-rapides.
• Autres procédés envisagés pour accélérer la résorption sous-cutanée des préparations insuliniques(8)
– Chauffage de la peau
L’objectif est d’augmenter le flux sanguin au point d’injection et d’accélérer la résorption de l’insuline injectée en chauffant la peau pour porter sa température à 38° C.
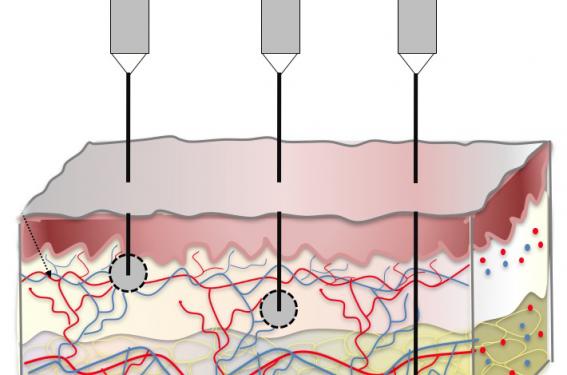
– Injection de l’insuline dans le derme superficiel
Cette approche consiste à injecter l’insuline, non pas dans le tissu cellulaire sous-cutané, mais dans le derme superficiel, à l’aide de microaiguilles dont la longueur est comprise entre 0,9 et 1,75 mm. Dans ces conditions, l’insuline est injectée dans une zone riche en vaisseaux lymphatiques et sanguins (figure 5). Dans cette zone, ces derniers ont une paroi très fine qui permet un passage rapide de l’insuline dans le torrent circulatoire. Dans l’hypoderme, c’est-à-dire dans la zone relativement profonde du tissu cellulaire sous-cutané, il existe une vascularisation assez abondante, mais avec des vaisseaux dont les parois sont plus épaisses que dans la région sous-épidermique. Quand l’injection est faite dans le derme profond avec des aiguilles relativement longues, la résorption est en théorie plus rapide que lorsque l’insuline est injectée dans le derme intermédiaire (figure 5). En résumé, l’absorption de l’insuline dépend de la zone cutanée dans laquelle on injecte le dépôt d’insuline : rapide dans la zone superficielle du derme, moyennement rapide dans l’hypoderme profond et relativement plus lente dans la zone intermédiaire (figure 5).
Figure 5. Vitesse d’absorption de l’insuline en fonction de la zone du tissu cellulaire sous-cutané dans laquelle elle est injectée : 1. rapide si le dépôt est effectué dans la zone sous-épidermique, 2. plus lente si le dépôt est effectué dans le derme, 3. intermédiaire si le dépôt est effectué dans l’hypoderme profond. La vitesse d’absorption dépend du degré de vascularisation du tissu cellulaire sous-cutané.
Conclusion
À ce jour, les conclusions sont plutôt maigres. Les gains en termes de délais et de durée d’action (quelques minutes) semblent relativement modestes quand on compare l’analogue ultra-rapide Faster-Aspart aux analogues rapides classiques (lispro, asparte et glulisine) commercialisés depuis près de 20 ans(10-12).
Le rapport bénéfice/coût sera primordial pour que le succès des analogues ultra-rapides soit au rendez-vous. De toutes manières, il faudra que leurs profils d’action soient encore améliorés pour se rapprocher un peu plus de celui des incréments glycémiques postprandiaux. Cette condition paraît indispensable afin que leur intérêt ne souffre d’aucune discussion. Si ce n’était pas le cas, on voit déjà se profiler les arguments des tenants des analogues rapides classiques : « puisque le gain ne se limite qu’à quelques minutes, il suffit de faire l’injection d’analogue rapide classique 5 à 10 minutes avant le début du repas et le résultat sera le même qu’avec une insuline ultra-rapide ».
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :