Thérapeutique
Publié le 14 avr 2013Lecture 13 min
L’apeline : cible prometteuse du traitement du diabète de type 2 ?
I. CASTAN-LAURELL, P. VALET, Inserm U1048, Institut des Maladies métaboliques et cardiovasculaires (I2MC), Université Paul Sabatier, Toulouse
L’apeline, peptide présent dans le sang et exprimé dans de très nombreux tissus, a été également identifié comme nouvelle adipokine (facteur produit et sécrété par les cellules adipeuses). La présence d’apeline dans le tissu adipeux a permis d’orienter des recherches sur le rôle de l’apeline dans un axe nouveau, celui du métabolisme énergétique et des dysfonctionnements associés au cours de l’obésité et du diabète de type 2. L’ensemble des travaux, réalisés pour l’instant sur un modèle animal d’obésité et de résistance à l’insuline, montre que l’apeline exerce des effets bénéfiques en améliorant la sensibilité à l’insuline.
L’apeline et son récepteur APJ
L’apeline, peptide identifié en 1998 par Tatemoto et al. à partir d’extraits d’estomac bovin, est issu d’un précurseur (pré-proapeline) formé de 77 acides aminés comprenant une séquence signal indiquant ainsi que l’apeline peut être sécrétée(1). À ce jour, les principales formes « actives » sont l’apeline formée de 36 acides aminés (apeline-36), l’apeline-17 et l’apeline-13 qui existe aussi sous forme pyroglutaminée (Pyr(1)-apelin-13), isoforme plus stable et la plus souvent utilisée pour tester les effets de l’apeline. Certains effets associés à l’apeline-12 ont cependant été rapportés. Il existe une très grande homologie de séquence entre les formes humaine, bovine et murine allant même jusqu’à une parfaite homologie pour les 23 derniers acides-aminés.
L’apeline, peptide ubiquitaire, s’est avéré être le ligand endogène d’un récepteur membranaire de la famille des RCPG (récepteur couplé aux protéines G) appelé APJ et qui était jusque-là orphelin. Ce récepteur, exprimé dans de nombreux tissus (encadré 1), présente une forte homologie avec le récepteur de type 1 de l’angiotensine II sans que pour autant l’angiotensine soit capable d’exercer des effets via APJ(2 pour revue).
L’apeline, APJ et l’insuline
Les premiers travaux montrant une relation possible entre l’apeline et le métabolisme énergétique viennent de l’identification de l’apeline dans le tissu adipeux(1) et de sa sécrétion par les adipocytes(3), ce qui a valu à l’apeline d’appartenir à la famille des adipokines. La production et la sécrétion d’apeline adipocytaire sont fortement augmentées par l’insuline aussi bien in vivo chez la souris qu’in vitro sur des lignées cellulaires d’adipocytes. Chez des sujets obèses et hyperinsulinémiques, l’expression de l’apeline dans le tissu adipeux est augmentée mais aussi l’apelinémie(3). Plusieurs études ont depuis mesuré les concentrations d’apeline chez des patients présentant des dysfonctionnements métaboliques(4 pour revue). Dans la plupart des études, les concentrations d’apeline sont en général plus élevées chez les patients obèses et diabétiques (tableau) mais peuvent revenir à des valeurs contrôles après chirurgie bariatrique ou restriction calorique. L’apelinémie ou les changements des concentrations plasmatiques d’apeline sont souvent corrélés positivement à ceux des triglycérides sériques, du glucose, du pourcentage d’hémoglobine glyquée (HbA1c) ou encore de l’HOMA-IR (Homeostasis Model Assessment of Insulin Resistance).
La relation entre insuline et apeline est réversible puisque l’apeline peut agir sur la sécrétion d’insuline. En effet, il a été montré in vivo chez la souris que l’apeline inhibe la sécrétion d’insuline stimulée par le glucose mais aussi in vitro sur des ilôts isolés. De plus, un traitement de 10 semaines à l’apeline améliore la morphologie des îlots pancréatiques et la teneur en insuline chez des souris Akita, un modèle de diabète de type 1.
L’apeline est également présente dans les cellules β ainsi que dans les cellules α de différentes espèces et son expression est augmentée dans les îlots des modèles de rongeurs diabétiques (souris db/db, rat GK). Cependant, la sécrétion d’apeline par les cellules pancréatiques n’a pas été démontrée. Enfin, le récepteur APJ étant présent également dans les cellules β, l’apeline pourrait agir comme un régulateur paracrine ou autocrine de la sécrétion d’insuline. Le récepteur APJ est aussi exprimé dans différents tissus impliqués dans le métabolisme énergétique comme le tissu adipeux ou les muscles. Avec l’obésité, l’expression d’APJ, comme celle de l’apeline, est augmentée dans le tissu adipeux humain et diminuée après une perte de poids induite par un régime hypocalorique. Il existe même une relation étroite entre l’expression d’apeline et d’APJ dans le tissu adipeux et les variations des taux d’insuline pourraient être impliqués dans les modifications d’expression à la fois d’apeline et d’APJ. Toutefois, cette régulation peut être différente selon la sévérité de la résistance à l’insuline. Par exemple, au cours de la transition jeûne/réalimentation, l’expression d’apeline et d’APJ est significativement augmentée dans le tissu adipeux de souris contrôles et obèses/insulinorésistantes mais pas dans celui des souris db/db diabétiques.
Chez l’homme, in vivo, lors d’un clamp hyperinsulinémique-euglycémique, on a pu noter également une augmentation de l’expression d’apeline et de son récepteur APJ après le clamp, dans des biopsies de tissu adipeux mais aussi de muscle squelettique. Au cours du même protocole, chez des patients diabétiques de type 2, seule l’expression d’APJ est augmentée dans le muscle. Ces données soulignent la nécessité d’études cliniques spécifiques et longitudinales chez l’homme afin de mieux définir la régulation de ce système dans les maladies métaboliques.
Ainsi, le lien étroit existant entre le système apeline/APJ, l’insuline et même la résistance à l’insuline ou le diabète de type 2 suggère fortement un rôle de l’apeline dans le métabolisme énergétique.
Effets métaboliques de l’apeline après traitement aigu (voie IV)
Les effets de l’apeline recherchés en premier lieu ont porté sur le métabolisme glucidique, par analogie aux effets de l’insuline. L’apeline (Pyr(1)-apelin-13) a, dans un premier temps, été injectée par voie intraveineuse chez des souris qui ne présentaient aucun désordre métabolique. Une dose qui double les concentrations plasmatiques d’apeline diminue la glycémie (effet maximal 30 minutes après injection) et améliore la tolérance au glucose lors d’une hyperglycémie provoquée par voie orale. Au cours d’un clamp euglycémiquehyperinsulinémique, avec une concentration d’insuline assurant l’inhibition de la production hépatique de glucose, la perfusion d’apeline au cours du clamp entraîne une hausse du débit de perfusion de glucose et permet une meilleure utilisation du glucose, en particulier par les muscles et le tissu adipeux blanc. En reconduisant la même expérience sur des souris obèses et prédiabétiques, alors que l’insuline n’a plus ou peu d’effets, la perfusion d’apeline facilite toujours l’utilisation du glucose en augmentant l’entrée de celui-ci dans les mêmes tissus insulinosensibles mais aussi dans le cœur.
Il a été démontré que ces effets de l’apeline sur les muscles et le tissu adipeux sont directs. Ainsi, l’apeline augmente le transport de glucose, que ce soit sur le muscle ou les adipocytes isolés ou sur différents modèles de lignées cellulaires (adipocytaire : 3T3-L1, musculaire : C2C12, cardiaque : H9C2). De plus, sur un modèle d’adipocytes en culture 3T3-L1 insulinorésistants, l’apeline stimule l’entrée du glucose avec une relation dose-effet. Dans ce modèle expérimental, l’apeline induit une translocation du transporteur du glucose GLUT4 du cytoplasme vers la membrane plasmatique par une voie impliquant PI3K/Akt. Même si l’apeline est capable d’activer des cibles de la voie insuline, elle se distingue de cette dernière car elle permet l’activation de l’AMPK dans les différents tissus. L’AMPK est une enzyme qui joue un rôle très important dans l’homéostasie énergétique et qui est activée dès qu’il y a une chute des taux d’ATP dans la cellule. L’AMPK favorise les voies qui produisent de l’ATP et donc celles qui oxydent les substrats énergétiques. L’AMPK est d’ailleurs activée par des antidiabétiques comme la metformine ou les thiazolidines.
Effets métaboliques de l’apeline après traitement chronique (voie IP)
Si les effets de l’apeline à court terme sont bénéfiques et sont essentiellement liés à une amélioration du métabolisme glucidique, il est également important de connaître les conséquences d’un traitement à plus long terme.
Une première étude, menée par un groupe japonais, a porté sur les effets d’un traitement par l’apeline pendant 14 jours (injection intrapéritonéale quotidienne) chez des souris de poids normal. À la fin du traitement, les souris ont un poids identique mais la masse des différents dépôts adipeux est significativement diminuée ainsi que leur contenu en triglycérides. De façon intéressante, les souris traitées à l’apeline ont une dépense énergétique augmentée due à une activation du tissu adipeux brun (augmentation de la protéine découplante UCP1 et de la température corporelle).
Ces résultats ont été renforcés par ceux obtenus dans un modèle de souris où l’expression de l’apeline a été invalidée (souris KO apeline). En effet, ces souris ont une adiposité abdominale importante et un taux élevé d’acides gras plasmatiques. Chez ces souris, l’infusion d’apeline pendant 2 semaines entraîne un retour à des valeurs contrôles des taux d’acides gras libres, de glycérol plasmatique ainsi que de l’adiposité, ce qui suggère ainsi un rôle de l’apeline dans la régulation de la lipolyse (hydrolyse des triglycérides).
In vitro sur la lignée adipocytaire 3T3-L1, l’apeline seule n’a pas d’effet sur la lipolyse mais elle est capable d’inhiber de façon modérée celle stimulée par un agoniste β-adrénergique. Ces résultats n’ont pas été retrouvés sur du tissu adipeux ou des adipocytes isolés humains. Même si les effets de l’apeline sur la lipolyse ne sont pas clairs (effet lipolytique in vivo et antilipolytique in vitro), restait à connaître le sort des acides gras relargués.
Une diminution de la masse grasse associée à une augmentation de l’activité lipolytique n’est bénéfique que si les acides gras sont ensuite utilisés et non stockés dans un autre tissu ou organe. L’apeline étant capable d’activer l’AMPK, elle-même stimulant l’oxydation des acides gras, cet effet a donc été étudié après un traitement de 28 jours par l’apeline dans les muscles (soleus) isolés de souris obèses et résistantes à l’insuline. Les effets du traitement par l’apeline sur le foie n’ont pas été étudiés car, dans les conditions basales, le foie exprime très faiblement le récepteur APJ. Dans le muscle (soleus en particulier), l’oxydation d’un acide gras exogène ([C14]-palmitate) est augmentée comparativement aux souris contrôles. De façon générale, dans un muscle insulinorésistant l’oxydation des acides gras est diminuée et liée à une élévation de l’oxydation incomplète qui se traduit par une augmentation des taux d’acylcarnitines, qui sont délétères et entraînent une résistance à l’insuline. Or, suite au traitement par apeline, l’oxydation incomplète n’est pas augmentée et les acylcarnitines à longue chaine sont même diminués dans le muscle.
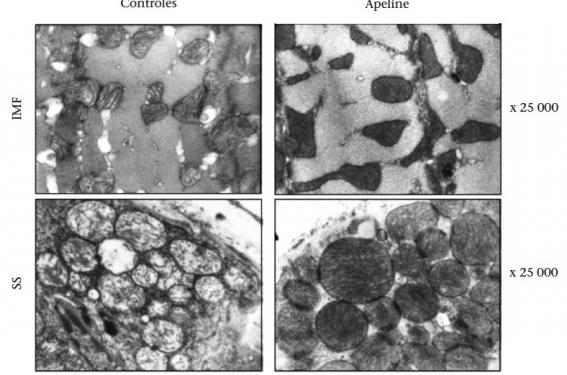
Cette meilleure utilisation des lipides s’accompagne d’une augmentation des capacités oxydatives puisque l’activité des différents complexes de la chaîne respiratoire mitochondriale est plus élevée, ce qui suggère un meilleur couplage entre le cycle tricarboxylique et l’oxydation des acides gras. De plus, la quantité des différents complexes de la chaîne respiratoire ainsi que l’expression de PGC1a est plus importante, ce qui est en faveur d’une biogenèse mitochondriale. Effectivement, dans les muscles de souris traitées par l’apeline, la densité des mitochondries est augmentée et une moindre altération de l’ultrastructure mitochondriale (moindre densité d’électrons de la matrice et perte des cristae) a été observée (figure 1)(6). Le dysfonctionnement mitochondrial musculaire au cours du diabète est de plus en plus pris en considération et toute amélioration de cette fonction est bénéfique. Par ailleurs, dans un modèle de souris transgéniques surexprimant globalement l’apeline, il a été également observé une résistance à l’obésité et une augmentation de la biogenèse mitochondriale dans le muscle avec un ratio en faveur des fibres de type I (oxydatives).
Figure 1. Photographie en microscopie électronique montrant les mitochondries intramyofibrillaires (IMF) et sous le sarcomère (SS) de muscles soléaires issus de souris obèses et résistantes à l’insuline après traitement à l’apeline (droite) ou pas (gauche). D’après Attané C et al(5).
Cette meilleure capacité oxydative du muscle suite au traitement apeline est associée à une meilleure sensibilité à l’insuline puisque le transport de glucose stimulé par l’insuline dans le muscle est augmenté. Les souris sont également plus tolérantes au glucose et à l’insuline et ont une moindre glycémie et une nette diminution de l’insulinémie. Les concentrations plasmatiques d’adiponectine (adipokine insulinosensibilisatrice qui diminue chez les animaux obèses/diabétiques) ne sont pas augmentées dans ce modèle ou celui des souris transgéniques. Cependant son expression tend à augmenter dans le tissu adipeux des souris traitées par l’apeline, ce qui est en accord avec la baisse de l’adiposité et l’amélioration de la sensibilité à l’insuline. L’adiponectine est également considérée comme une adipokine antiinflammatoire, les taux de TNFα étant la plupart du temps en miroir inverse de ceux de l’adiponectine. L’apeline, quant à elle, semble avoir un effet mineur sur cet aspect in vivo, l’expression de TNFα ou d’IL-6 étant diminuée de façon non significative dans le tissu adipeux. Cependant une diminution d’IL-6 en réponse à l’apeline a été montrée sur des adipocytes en culture (lignée 3T3-L1) rendus résistants à l’insuline.
Ainsi un traitement chronique à l’apeline de 28 jours exerce aussi de nombreux effets bénéfiques sur les tissus métaboliques en particulier sur le muscle squelettique (figure 2). Pour l’instant, des effets adverses n’ont pas été mis en évidence. Malgré des concentrations élevées d’apeline plasmatique dans un état prédiabétique, un traitement par l’apeline ne semble pas ainsi conduire à une résistance à l’apeline. L’approche chez l’homme est essentielle pour confirmer le rôle de l’apeline sur le métabolisme glucidique. Même si quelques molécules mimant ou bloquant les effets de l’apeline ont déjà été mises en évidence (encadré 2), elles n’ont pas été testées vis-à-vis des effets métaboliques. Le développement de ligands non peptidiques spécifiques d’APJ ne peut être que profitable en vue de futures investigations cliniques.
Figure 2. Schéma résumant les principaux effets d’un traitement par l’apeline sur le muscle et le tissu adipeux de souris rendues obèses et résistantes à l’insuline par un régime hyperlipidique (HFD).
Conclusion
L’apeline en aigu par voie intraveineuse diminue la glycémie et améliore la sensibilité à l’insuline chez des animaux obèses et résistants à l’insuline.
L’apeline in vitro sur des cellules pancréatiques inhibe la sécrétion d’insuline.
L’apeline en traitement chronique diminue la masse grasse, augmente le métabolisme oxydatif et la biogenèse mitochondriale dans le muscle et améliore aussi l’équilibre glycémique.
L’apeline a été montrée comme étant cardioprotectrice dans des situations pathologiques.
Cet ensemble de critères correspond en partie à ceux auxquels devrait répondre un traitement du diabète de type 2 et font ainsi du système apeline/APJ une cible prometteuse.
« Je déclare ne pas avoir de conflit d’intérêt en rapport avec cet article »
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :